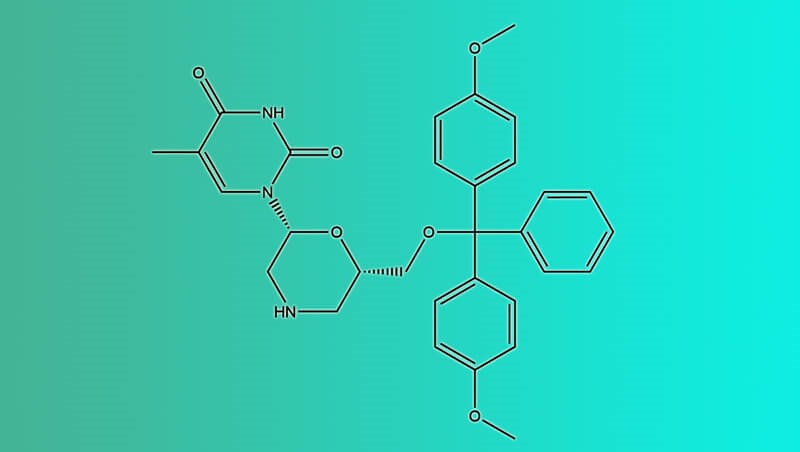
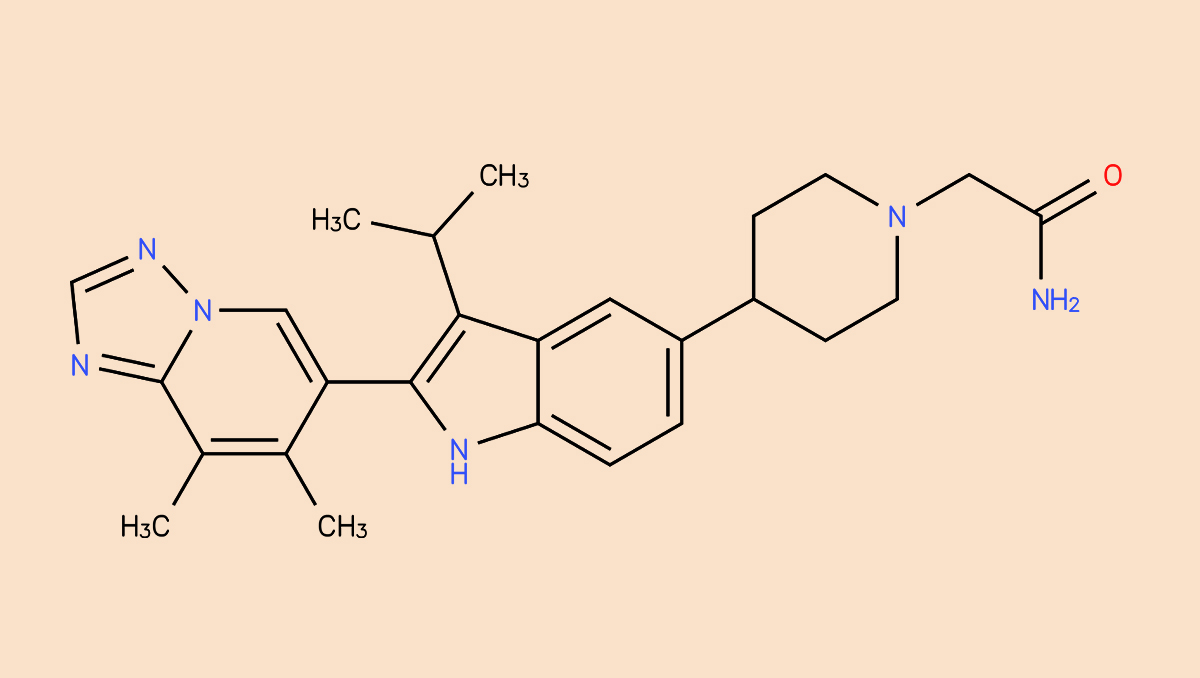
开发具有高口服生物利用度的速释片
近年来,自动化有机合成、高通量筛选和合理药物设计的进步导致大量已上市的药物和候选药物的水溶性较差,这极大地限制了药物的口服生物利用度。对于具有良好渗透性但水溶性较差的药物,已开发出提高溶解度并促进口服给药的制剂策略。在这些增溶策略中,无定形固体分散体 (ASD) 是一种有效且广受使用的技术。制备 ASD 最常用的两种方法是喷雾干燥和热熔挤出 (HME)。
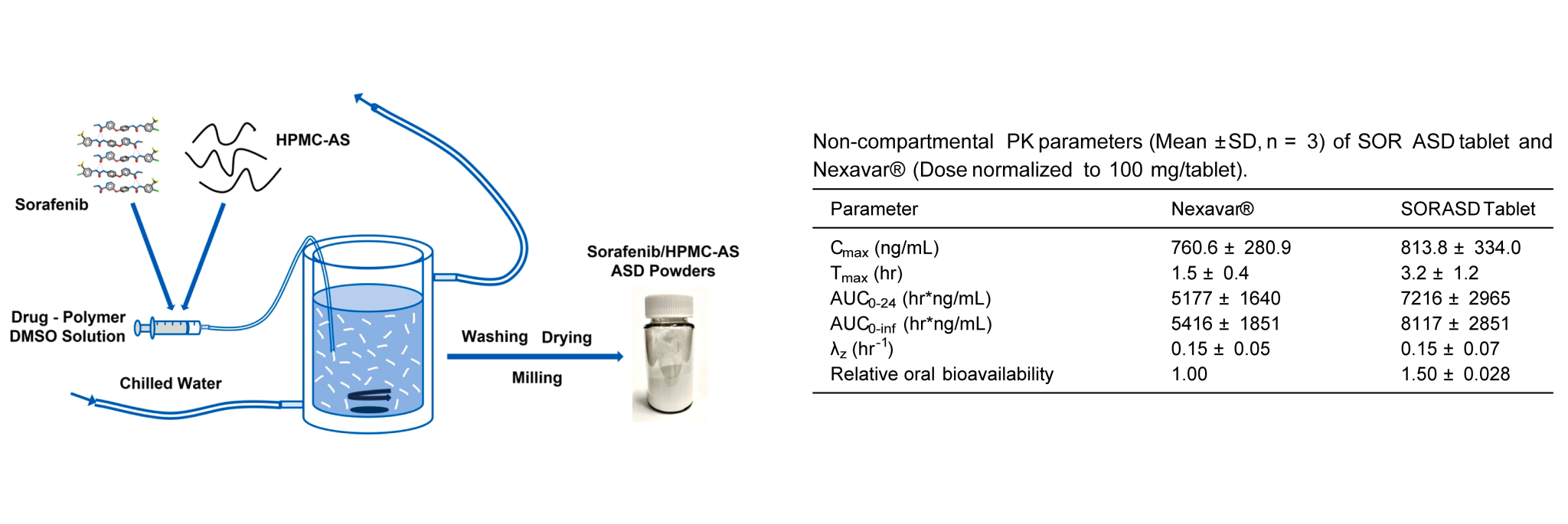
索拉非尼 (SOR) 是一种用于治疗肝癌的药物,室温下在 50 mM pH 6.8 磷酸盐缓冲盐液 (PBS) 中难溶(约 10 ng/mL) 。索拉非尼的市售片剂产品Nexavar®含有甲苯磺酸盐 (SOR-Tosy),在禁食状态下,相对口服生物利用度为 38-49% (与口服溶液相比) 。已经尝试了几种制剂策略来提高 索拉非尼的口服生物利用度,包括纳米复合物、纳米颗粒、悬浮液、自微乳化药物递送系统等等。
在本研究中,科研人员探索了通过共沉淀开发生物利用度更高的索拉非尼片剂的可能性。索拉非尼在挥发性溶剂中的低溶解度及其在熔点 (~212 °C) 以上的不稳定性排除了喷雾干燥和热熔挤出作为制备 ASD 的可行方法。科研人员采用了一种节约材料和加速片剂开发方法,该方法以使用预测工具对粉末和片剂进行系统表征为指导。使用雄性比格犬(约 10 kg 体重) 对索拉非尼 ASD 片剂和 Nexavar® 片剂的药代动力学进行了评估,给药间隔为一周。每次给药前将狗禁食过夜,并在给药后4小时给予食物。 给予口服片剂后立即用大约 10 mL 反渗透水灌胃。在给药后 0.25、0.5、1、1.5、2、4、6、8 和 24 小时从颈静脉采集血样(~1 mL)。在冰上将血样储存在含有 K2-EDTA 的真空采血管中。随后将样品在 2-8 °C 下以 2200 g 离心 10 分钟,分离血浆并在 -80 °C 下储存,直到通过 LC-MS/MS-18 进行分析。从索拉非尼的血浆浓度-时间曲线来看,服用 SOR ASD 片剂后的暴露量 (AUC0-inf) 为 8117±2851 hr*ng/mL,显着高于 Nexavar® 的 AUC0-inf (5416±1851 hr*ng/mL)。SOR ASD 片剂的最大血浆浓度 (Cmax) (813.8±334.0 ng/mL) 略高于 Nexavar® (760.6±280.9 ng/mL)。ASD 和 Nexavar® 片剂的 Tmax 值分别为 3.2±1.2和 1.5±0.4 小时。与Nexavar®片剂产品相比,SOR ASD的口服生物利用度也相对提高了 50%。
综上所述,在了解材料特性和制造工艺的驱动下,节省材料和加快片剂开发的方法可以扩展到 ASD 片剂的开发。
参考文献:
[1] Sichen Song, et al. Efficient development of sorafenib tablets with improved oral bioavailability enabled by coprecipitated amorphous solid dispersion. Int J Pharm (IF: 5.88; Q1). 2021 Dec 15;610:121216. doi: 10.1016/j.ijpharm.2021.121216.


.jpg)