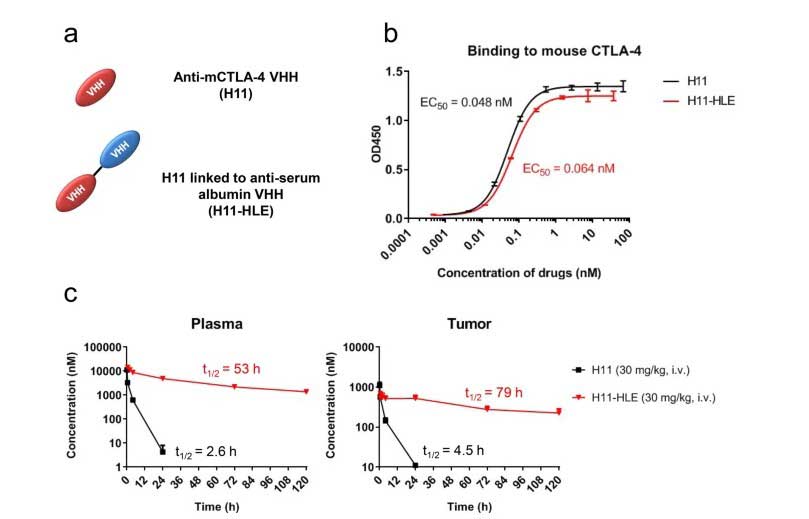
迎光而立——世界银屑病日
今天是第 19 个“世界银屑病日”。银屑病是目前最常见的自身免疫性疾病之一,被喻为“上帝纹身”,在人群的发病率约为2-3%。其发病原因及发病机制均尚未完全明晰,目前认为是遗传和环境因素共同作用导致。构建理想的银屑病动物模型是银屑病发病机制和开展药物治疗研究的关键。当前应用于研究的银屑病动物模型种类较多(自发性、诱发性、异体移植和基因修饰型),各类模型都有各自的特点及局限性,但目前还不存在一种动物模型能够全面模拟银屑病发生、发展的过程。
银屑病及其机理研究
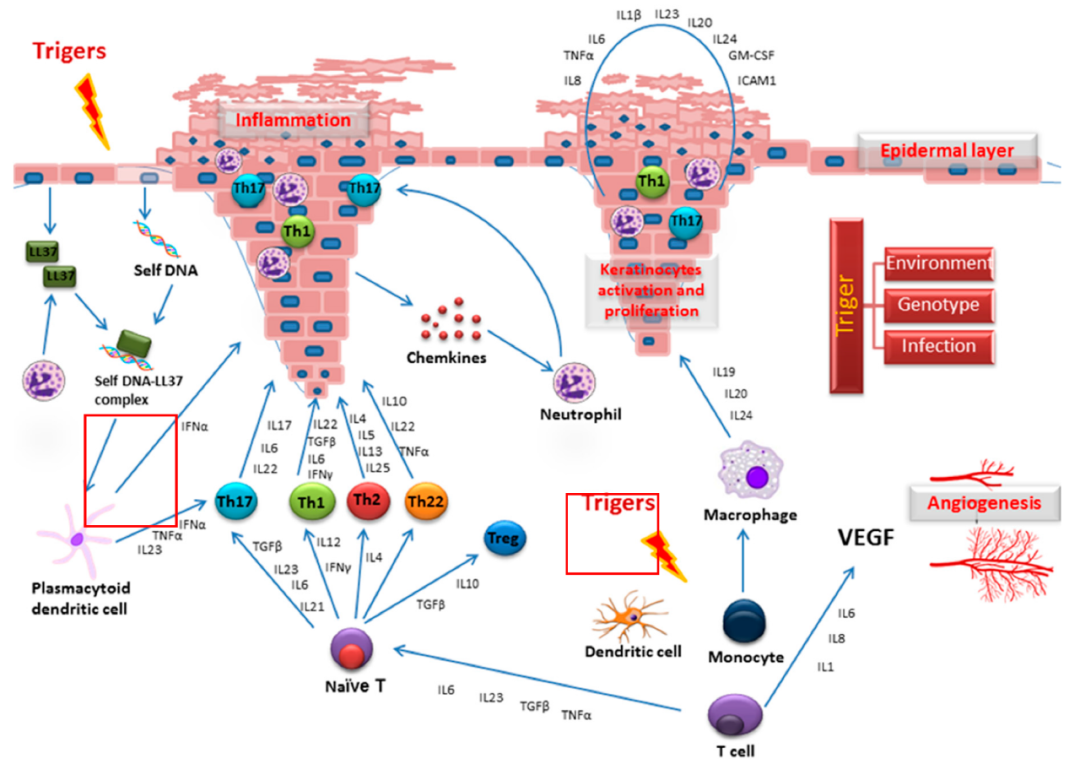
银屑病(psoriasis),俗称“牛皮癣”,是一种常见并易复发的慢性炎症性皮肤病,主要表现为躯干、四肢的特征性红色丘疹、斑块及银白色鳞屑,部分患者可合并关节症状。银屑病的特征是免疫细胞浸润、表皮过度增殖和角质形成细胞分化异常。银屑病具有显着的地域差异,赤道地区发病率最低,向两极增加。对银屑病发病机制的深入了解已经产生了越来越多的药物靶点和分子药物。其分子机理研究表明患者体内免疫细胞过度释放促炎症因子(如IL-17等),先天及获得性免疫系统长期处于激活状态,从而引发多组织及器官的持续性损伤,其中角质形成细胞、树突状细胞和T细胞扮演了重要角色。
银屑病发展的关键信号通路
在过去十年中,在阐明银屑病的分子发病机制方面取得了重大进展。转录组学分析已广泛用于鉴定与银屑病病理相关的差异表达基因 (DEG)。全基因组关联研究 (GWAS) 已经确定了多种遗传变异和银屑病易感基因。尽管现在对赋予疾病易感性的基因了解越来越深入,但对定义疾病分子特征的表达基因的调控网络还知之甚少。已经鉴定了几种在银屑病转录组中被激活或抑制的转录因子 (TF)。除了重要的 mRNA 表达改变外,银屑病的特征还在于特定的 microRNA 表达谱,与健康皮肤的表达谱不同。此外,通过Meta分析 (Meta-analysis) 得到一致的候选基因参考列表,用于进一步研究银屑病病理学和新的治疗靶点。
银屑病是一种 T 细胞介导的慢性炎症性皮肤病。银屑病目前尚无法完全治愈,只能通过药膏,光疗,免疫抑制剂等疗法控制症状。由于缺乏合适的动物模型极大地阻碍了对银屑病发病机制的研究。但目前已经开发了多种转基因、敲除和重组的银屑病模型。尽管存在局限性,但这些模型已经证明皮肤中的角质形成细胞增生、血管增生和细胞介导的免疫密切相关。将受累和未受累的银屑病皮肤移植到免疫缺陷小鼠身上的异种移植模型是唯一接近整合该疾病的完整遗传、免疫和表型变化的模型。
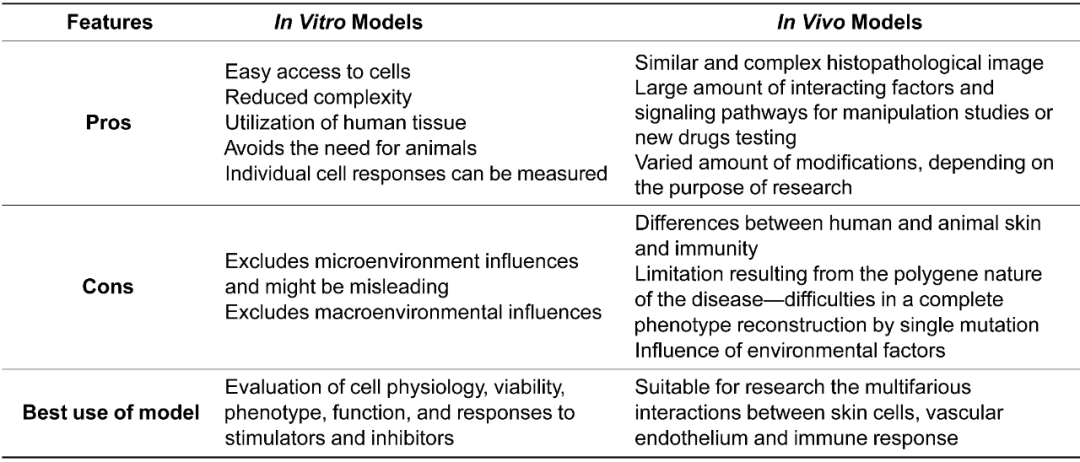
不同模型比较
银屑病类型
银屑病可以分为寻常型银屑病、脓疱型银屑病、红皮病型银屑病、关节病型银屑病,每一种银屑病都有自身的形态特点,通过肉眼可以分辨出来。寻常型银屑病最为常见,又分为点滴型、斑块型、屈侧银屑病等,典型的表现为红斑、鳞屑性皮疹,刮去层层鳞屑,可见薄膜现象和点状出血。脓疱型银屑病,在红斑或正常皮肤上出现针尖大脓疱。红皮病型银屑病,红斑面积超过体表面积90%以上,周身大面积脱屑,伴有发热等。关节病型银屑病,有类风湿关节炎的表现,可出现关节畸形等表现。红皮病型和脓疱型银屑病,经常由寻常型银屑病治疗不当发展、加重而来。银屑病患者受累皮肤的主要发现包括由于浅表血管扩张和表皮细胞周期改变导致的血管充血。这种变化被认为与炎症过程中释放的各种炎性细胞因子有关,如肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)和白细胞介素-17(IL-17)。
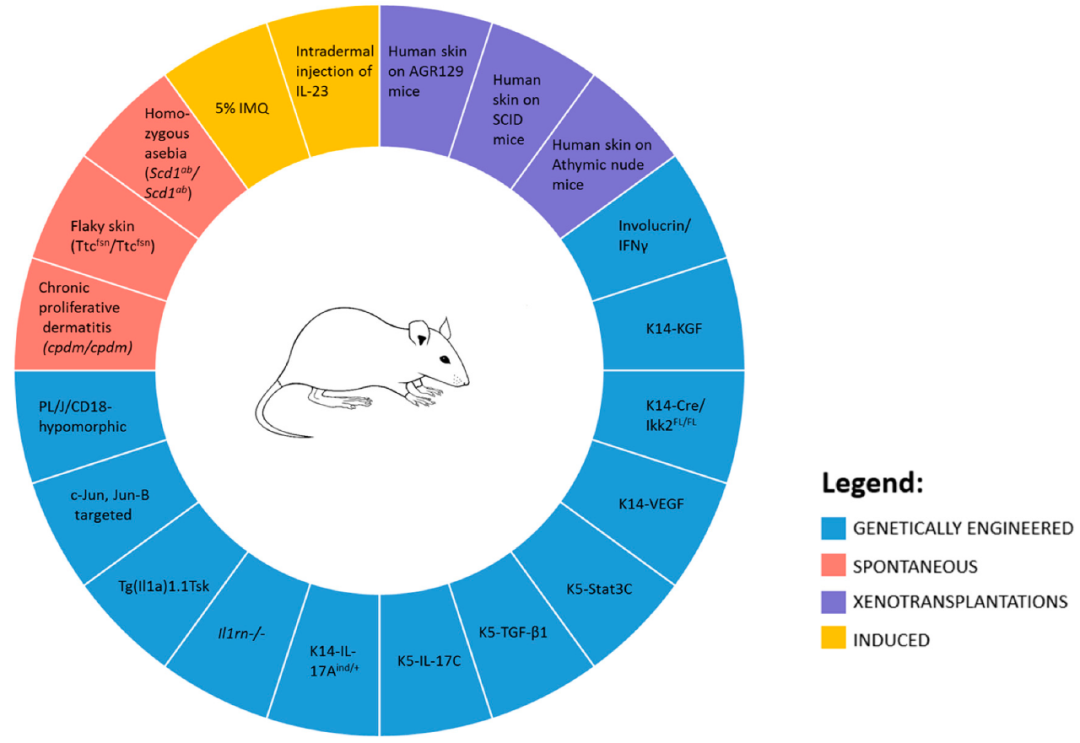
建立银屑病动物模型
大多数动物疾病模型可分为 (i)自发、(ii) 转基因、(iii)诱导、(iv) 阴性或 (v)孤儿,其中前三种最为丰富。自发和转基因模型是模仿人类状况的遗传变异体。诱导模型的特点是通过手术或基因改造或化学注射来创建。阴性模型主要用于研究抗病机制,而孤儿模型是人类中没有相应疾病的动物。
银屑病小鼠模型
自发性银屑病动物模型
自发产生银屑病样病变的小鼠模型目前有缺皮脂(asebia,ab/ab)突变鼠、鱼鳞状皮肤(ichthyosis,ic/ic)突变鼠,无毛(hairless,hr/hr)突变鼠和“鳞片状皮肤”(flaky skin,fsn/fsn)突变鼠等。纯合子 asebia (Scd1ab/Scd1ab) 鼠是第一个角化过度的模型。皮脂腺的丧失是由 Scd1基因(编码硬脂酰辅酶 A 去饱和酶)突变引起的。因此,成年Scd1ab/Scd1ab 鼠的皮肤变得鳞片状,表皮棘层肥厚,血管化增加,巨噬细胞和肥大细胞大量涌入。在增厚的表皮中,长毛囊以锐角延伸到深层皮下组织。真皮变得过度生长,成纤维细胞密度更高。自发性慢性增生性皮炎突变(Sharpincpdm/Sharpincpdm)模型显示出多种银屑病特征。小鼠皮肤变得红色和片状,血管扩张。此外,皮肤被嗜酸性粒细胞、巨噬细胞和肥大细胞占据。这种表型可以使用皮质类固醇逆转,但不能通过环孢菌素A逆转。
诱发性银屑病动物模型
受限于模型建立难度和成本,直接诱发类模型使用最为广泛。研究表明主要是通过实现以下几方面而诱导动物产生银屑病:
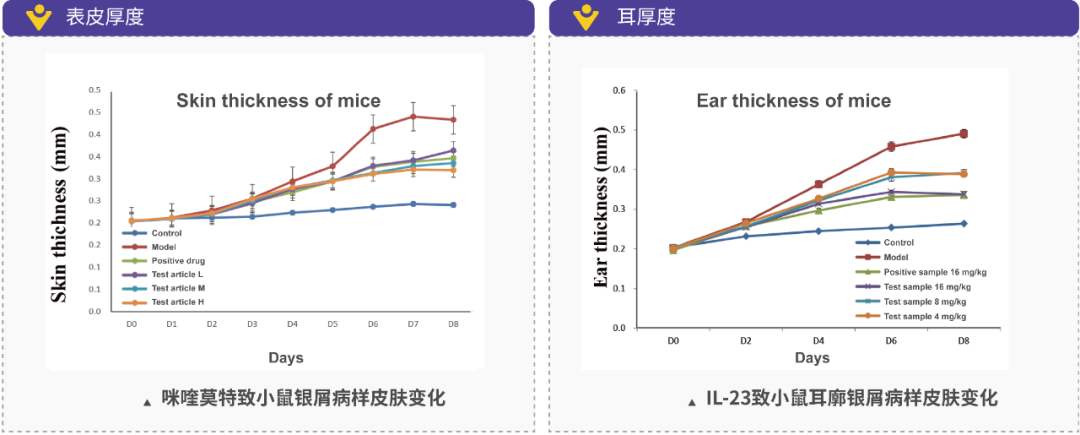
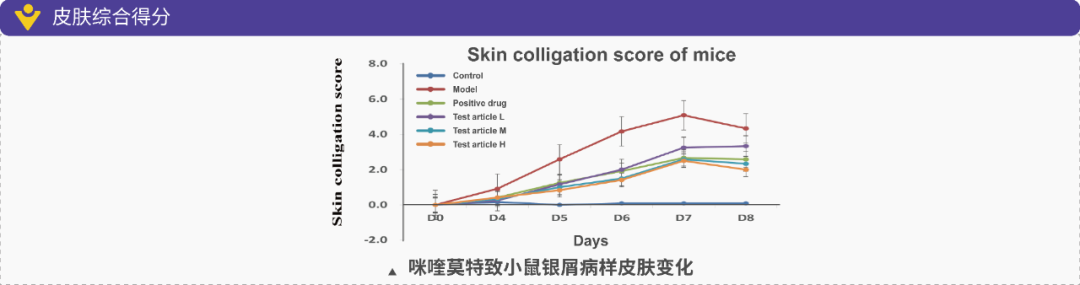
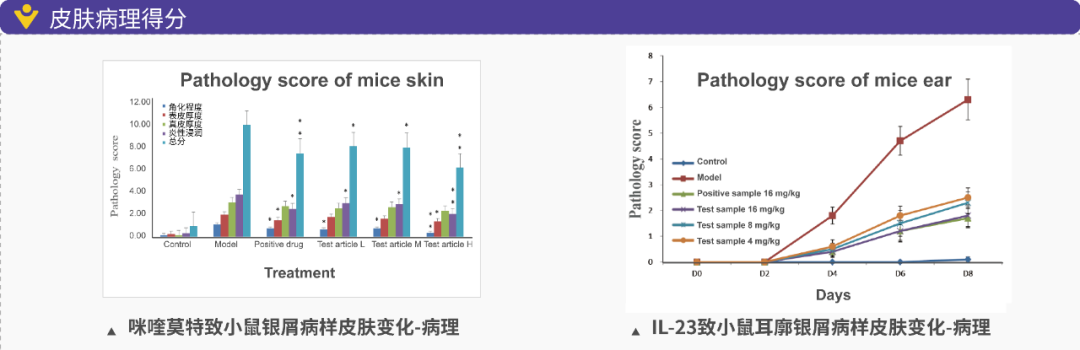
1)激活天然免疫系统,如涂抹Imiquimod (咪喹莫特,IMQ)激活TLR7/8信号通路;咪喹莫特(5%)诱导小鼠模型:咪喹莫特为Toll样受体7/8激动剂,能激活固有免疫系统导致中性粒细胞、γδ T细胞产生炎症因子等,诱导小鼠出现银屑病样皮损;
2)激活功能失调T细胞反应,如免疫缺陷小鼠移植CD4+,CD8+,Th17细胞等;T细胞移植模型的成功表明了体内调节性T细胞亚群的功能失调在银屑病发病机制中的重要作用。
3)打破细胞因子平衡,直接将细胞因子注入小鼠皮肤或耳廓,造成皮肤或耳廓出现银屑病样皮损,建立银屑病模型。常用的皮下注射细胞因子包括IL-6、IL-21、IL-12、IL-23等,可在短时间内造就银屑病样皮损;
4)破坏血管或皮肤神经功能,如过表达或抑制血管生成因子等
异体移植银屑病动物模型
异体移植模型包括异种移植模型和同种不同品系小鼠间移植模型。后者主要是指给免疫缺陷小鼠静脉注射不同品系小鼠主要组织相容性复合体(MHC)不相容的免疫细胞进行免疫重建。异种移植银屑病动物模型是将银屑病患者的皮损直接植入免疫缺陷的小鼠,使移植物维持或产生银屑病样表型。最常用到的小鼠受体有裸鼠、SCID小鼠和AGR129小鼠。
异种移植模型的主要优点在于采用了人体来源的组织,最接近人类疾病的免疫和遗传基础,在临床前研究中,对于观察新药物的疗效、代谢、不良反应等均有很大优势。此类模型不仅能表现出银屑病样外观改变,而且能在较长时间内较好地保持复杂的病理生理变化。其局限性在于只是复制银屑病的皮肤局部反应,不能反映银屑病的整体发病情况。
然而,构建这种模型需要较大量的供体组织,供体取材后需要立即进行移植以防止移植物缺血,对操作技术要求较高。另外,由于移植物的质量参差不齐和宿主小鼠体内缺乏与银屑病患者相似的内环境(如缺乏银屑病相关细胞因子的高表达),也可能导致研究结果出现偏差,这些局限性均限制了异种移植模型在银屑病研究中的广泛应用。
基因修饰银屑病动物模型
银屑病发病过程中有大量细胞因子、黏附因子、转录因子以及其他炎性介质参与。如IL-6、TGF-α可以促进角质形成细胞增殖,IL-1、TNF-α、VEGF 诱导血管生成并趋化体内炎症细胞。转基因或基因敲除技术为研究这些因子的功能提供了高效的平台。
根据基因工程技术的特点,银屑病小鼠模型主要分为条件性基因敲除和先天性基因表达异常小鼠模型。前者是在小鼠成年以后,通过注射枸橼酸他莫昔芬特异性敲除角质形成细胞内的某些蛋白质而诱发银屑病,更接近于人类银屑病的发生过程。后者是通过特异性细胞内基因敲除或插入技术,使小鼠出生时即有角质形成细胞内蛋白质表达增多或缺失,更接近于先天性疾病的发病模式。
基因工程动物模型为在体研究关键因子的功能提供了平台,揭示了部分因子在银屑病发生发展中的重要作用。这些模型也能够成为研究细胞因子或因子受体拮抗剂的工具,以利于临床药物筛选。然而,事实表明,单一因子的变化并不足以诱发完整的银屑病病理过程。具有银屑病表型的动物模型,亦不能真实模拟银屑病发病过程中细胞因子网络的相互作用。
美迪西银屑病药效评价模型平台
银屑病是世界范围内的常见皮肤病,是一种即跟遗传有较强关系,又同时与环境明显相关的疾病,目前其致病机理也尚未明确。美迪西模拟银屑病的建模模型种类有IL-23诱导小鼠耳廓表皮异常增生模型咪喹莫特诱导的小鼠银屑病样模型小鼠阴道上皮有丝分裂模型小鼠尾部鳞片模型
试验结果的指标参数可以包括:
总结与展望
目前由于银屑病本身病因以及发病机制的不确切,尚且没有和人类银屑病完全吻合的动物模型,因此在众多类型的银屑病模型中,结合自己的研究目的,恰当的选取模型类型十分重要。
参考文献
[1]Katarzyna Bocheńska, et al. Models in the Research Process of Psoriasis. Int J Mol Sci. 2017 Nov 24;18(12):2514. doi: 10.3390/ijms18122514.
[2] Michael P Schön, et al. Animal models of psoriasis-highlights and drawbacks. J Allergy Clin Immunol. 2021 Feb;147(2):439-455. doi: 10.1016/j.jaci.2020.04.034.
[3] Yue Gao, et al. Human IL-23R Cytokine-Binding Homology Region-Fc Fusion Protein Ameliorates Psoriasis via the Decrease of Systemic Th17 and ILC3 Cell Responses. Int J Mol Sci. 2019 Aug 26;20(17):4170. doi: 10.3390/ijms20174170.
[4]Johann E Gudjonsson, et al. Mouse models of psoriasis. J Invest Dermatol (IF: 8.55; Q1). 2007 Jun;127(6):1292-308. doi: 10.1038/sj.jid.5700807. Epub 2007 Apr 12.